Principio cero de la termodinámica
Este principio, establece que existe una determinada propiedad denominada temperatura empírica θ, que es común para todos los estados de equilibrio termodinámico que se encuentren en equilibrio mutuo con uno dado.
Osea en pocas palabras: «Si pones en contacto un objeto frío con otro caliente, ambos evolucionan hasta que sus temperaturas se igualan».
Tiene una gran importancia experimental «pues permite construir instrumentos que midan la temperatura de un sistema.»
El equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir o dar a conocer un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, coordenadas en el plano x, y)
Este principio fundamental, aún siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes.
Primera ley de la termodinámica
También conocida como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
Osea: "La energía ni se crea ni se destruye: solo se transforma"
Osea: "La energía ni se crea ni se destruye: solo se transforma"
Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Léonard Sadi Carnot en 1824, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Clausius y Lord Kelvin para formular, de una manera matemática, las bases de la termodinámica.
La ecuación general de la conservación de la energía es la siguiente:

Que aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de la forma:
Esta es la segunda representación matemática
2.
Esta es la segunda representación matemática
2.
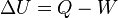
Donde U es la energía interna del sistema (aislado), Q es la cantidad de calor aportado al sistema y W es el trabajo realizado por el sistema.
Esta última expresión es igual de frecuente encontrarla en la forma ∆U = Q + W. Ambas expresiones, aparentemente contradictorias, son correctas y su diferencia está en que se aplique el convenio de signos IUPAC o el Tradicional (véase criterio de signos termodinámico).
Segunda ley de la termodinámica
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el primer principio.
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.
Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin.
Tercera ley de la termodinámica
La tercera de las leyes de la termodinámica, propuesta por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos.
Es importante remarcar que los principios o leyes de la termodinámica son válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel microscópico. La idea del demonio de Maxwell ayuda a comprender los límites de la segunda ley de la termodinámica jugando con las propiedades microscópicas de las partículas que componen un gas.
Preguntas ._.
1-¿básicamente que dice la primera ley?
2-¿cual es la aplicación mas conocida? y ¿porque?

En esta entrada hay una parte donde las letras se hacen muy grandes!!
ResponderEliminarHa mejorado muchoo el aspecto dle blog, sin embargo el fondo no está muy relacionado con el tema. Sería excelente que vuelvan a leer la información para que resuman y reformulen lo planteado.
ResponderEliminar1. Si un sistema le transfiere calor a otro su energía cambiará
ResponderEliminarAtt: Nataly
P.D: Me da miedo su blog, jajaja...